研究人员为更安全的基因驱动测试和开发创建新系统
科学家们继续扩大CRISPR的技术前沿,以及它在从人类健康到全球食品供应等领域的巨大潜力。基于CRISPR的基因驱动就是这种情况,这是一种基因编辑工具,旨在影响遗传元素如何从一代传递到下一代。
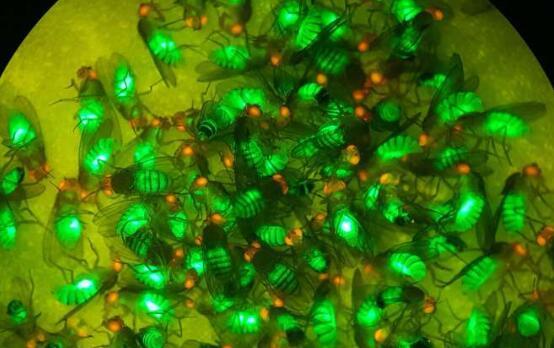
为蚊子设计的基因驱动有可能遏制疟疾感染的传播,疟疾感染每年导致数十万人死亡,但 安全问题 之所以提出,是因为这种驱动力可以迅速传播并主导整个种群。科学家们通过测试构成驱动装置的许多不同组件组合,探索了控制基因驱动元件在目标人群(如蚊子)中传播的原理。然而,他们发现还有更多需要探索的地方,关键问题仍然存在。
在期刊上 自然通讯,由前博士后学者Gerard Terradas领导的加州大学圣地亚哥分校研究人员与博士后学者Zhiqian Li和Ethan Bier教授密切合作,与加州大学伯克利分校研究生Jared Bennett和副教授John Marshall密切合作,描述了一种用于在实验室中测试和开发基因驱动并将其安全地转化为潜在实际应用工具的新系统的开发。
“这些研究[...]赋予基因驱动系统的新工程,同时提供了有关如何评估和分析其最重要运动部件之间关键相互作用的重要信息,”生物科学学院细胞与发育生物学系的教员Bier说。
基于CRISPR的基因驱动具有一种称为Cas9核酸内切酶的蛋白质和引导RNA分子,它们联手将DNA切割引导到基因组中的特定位点,其中新的 遗传元素 可以插入。当DNA修复这些切割时,新的遗传元素从一个染色体复制到另一个染色体,导致后代超过标准的50-50%遗传,而不是有利于新插入的遗传元素。
基因驱动有两种“口味”。 全基因驱动(fGD)在连接的单一包装中携带Cas9和引导RNA组分。相比之下,分裂驱动(sGDs)由两个遗传元件组成,它们分别携带Cas9和引导RNA组分,并插入基因组中的不同位点。分裂驱动被认为比fGDs更安全,因为可以单独控制和测试每个元件携带的组分,或者在它们逐渐放大gRNA组分频率的条件下。研究人员设计了这两个元素,最终重新连接,以提供完整基因驱动的效果。
就根除疟疾而言,全基因驱动产生了相当大的热情,因为它们有可能作为转移阻止引起感染的疟疾寄生虫传播的元素的载体。但fGDs也引起了人们的关注,因为它们有可能迅速传播并可能改变整个蚊子种群的基因组成。试验fGD需要高安全性的屏障和限制,以防止携带此类驱动器的昆虫意外逃逸到开放环境中。
拆分的情况并非如此 基因驱动.由于关键元素是分开的,sGD意外传播的风险要小得多,研究人员对其安全操作有更多的控制权。sGD的实验可以在传统的实验室设施中进行,从而为测试其潜力提供了更大的灵活性。
然而,科学家们在开发有效将sGD转化为功能齐全的fGD的系统方面受到了挑战。目前将sGD系统转换为fGD面临的一个挑战是它们依赖于两个独立的遗传组件,每个组件都必须表现出有效的驱动特性。
现在,加州大学圣地亚哥分校最近率先开发基因驱动和相关技术的科学家创建了一个灵活的基因“黑客”系统,用于将sGDs转化为fGDs。工作地点 果蝇,研究人员开发了一种新颖的遗传策略,该策略采用了由sGD的Cas9部分携带的特殊设计的引导RNA。这种黑客工具切割了sGD的复制成分并触发了遗传交换或“重组事件”,将Cas9插入携带向导RNA的元件中,从而产生了功能齐全的fGD。
“首先,也是最重要的,这项研究为sGD到fGD的敏捷遗传转化提供了原理证明,这应该极大地有助于测试和开发新的优化基因驱动系统,”论文第一作者Terradas说,他现在在宾夕法尼亚州立大学。
一旦研究人员开发了他们新的sGD-to-fGD黑客系统,一些令人惊讶的结果开始出现。正如预期的那样,新被黑客入侵的fGD在笼子实验中传播了苍蝇种群。然而,它的传播速度出乎意料地比模型预测的传统fGD要慢。
研究合作者Bennett和Marshall开发了一个数学模型,提供了解释。他们的模型显示,在黑客转换过程中,fGD对个体苍蝇的适应成本高于单独的sGD。这种适应成本在驱动元件自我复制时展开,在作用于群体中所有潜在的目标染色体后消失了。
“这项研究揭示了基因驱动组件如何协同工作的意想不到的复杂性,揭示了人们不能简单地假设单独的组件在结合在一起时如何相互作用,”Bennett说。
该论文的完整作者名单包括Gerard Terradas,Jared Bennett,Zhiqian Li,John Marshall和Ethan Bier。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
