RNA脂质纳米颗粒工程阻止肝纤维化 逆转损伤
自 疫苗成功以来,RNA 疗法一直是生物技术界越来越感兴趣的对象。这些疗法与您的身体合作,以针对疾病和感染的遗传根源,这是一种有前途的替代治疗方法,可以替代传统药物。
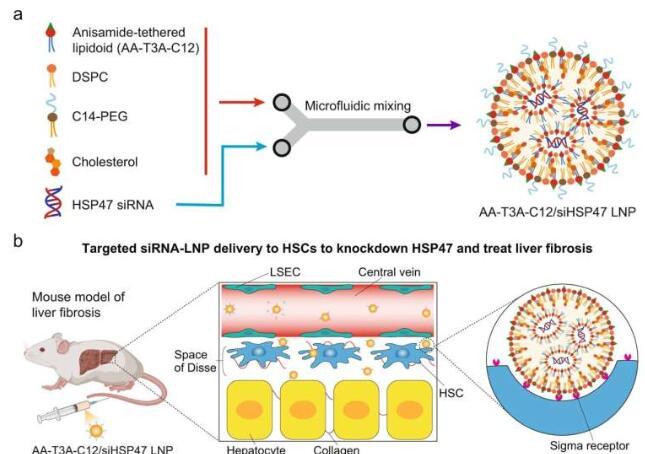
脂质纳米颗粒(LNP)已成功用于 药 几十年来。FDA批准的疗法将它们用作递送信使RNA(mRNA)的载体,信使RNA(mRNA)促使细胞产生新的蛋白质,以及小干扰RNA(siRNA),指示细胞沉默或抑制某些蛋白质的表达。
开发成功的RNA疗法的最大挑战是其靶向递送。研究现在正面临着LNPs目前的局限性,这使得许多疾病没有有效的RNA治疗。
当肝脏反复受损并且愈合过程导致疤痕组织积聚,阻碍健康的肝功能时,就会发生肝纤维化。它是一种慢性疾病,其特征是富含胶原蛋白的细胞外基质(ECM)过多。由于缺乏靶向活化的肝驻留成纤维细胞的递送系统,使用RNA疗法治疗肝纤维化仍然具有挑战性。固体成纤维细胞结构以及缺乏靶向这些成纤维细胞的特异性或亲和力都阻碍了当前的LNP进入活化的肝驻留成纤维细胞,因此它们无法提供RNA治疗药物。
为了解决这个问题并帮助为数百万患有这种慢性疾病的人提供治疗,生物工程系创新助理教授Michael Mitchell,J. Peter和Geri Skirkanich以及博士后研究员Xuexiang Han和Ningqiang Gong发现了一种合成配体系留LNP的新方法,增加了它们的选择性并允许它们靶向肝成纤维细胞。
Lulu Xue,Margaret Billingsley,Rakan El-Mayta,Sarah J. Shepherd,Mohamad-Gabriel Alameh和Roberts家庭疫苗研究教授兼佩雷尔曼医学院宾夕法尼亚RNA创新研究所所长Drew Weissman也为这项工作做出了贡献。
他们的研究发表在 自然通讯,显示了将小分子配体掺入可电离脂质(LNP的关键成分)的合成中,如何与肝脏中负责胶原蛋白积聚的臭名昭著的难以靶向的活化成纤维细胞产生亲和力。
胶原蛋白的积累伴随着热休克蛋白47(HSP47)的表达增加,HSP47是驱动胶原蛋白生物发生和分泌的蛋白质。HSP47的过表达和增加的胶原蛋白生物发生最终进展为纤维化。
一旦它们的LNP到达并进入靶细胞,siRNA就会被释放出来,从而沉默HSP47的表达,抑制胶原蛋白的产生并阻止纤维化。该治疗在小鼠中被证明是成功的,是人类肝纤维化的有希望的治疗方法。
这种可电离脂质合成的新方法是为RNA疗法治疗各种疾病打开更多大门的关键。
“为了使LNP具有足够的选择性以靶向肝星状细胞,即那些驱动纤维化的细胞,我们将茴香胺配体(一种对这些星状细胞上的受体具有高亲和力的分子)掺入可电离脂质的结构中,”米切尔说。“从本质上讲,我们创建了一个锁和钥匙机制来定位和解锁这些难以到达的细胞的交付。
合成过程是由Han及其同事开发的“一锅两步”过程。为了创建一个可电离脂质库,该团队首先将茴香胺配体(AA)前体和不同的氨基核放在一起。然后,他们添加疏水尾巴以产生AA系留的可电离脂质。选择异构胺作为配体是由于其中性和稳定性以及它对星状细胞上过表达的sigma受体的亲和力。一旦创建了AA系留LNP文库,研究小组就通过两轮选择过程分析了它们靶向和向细胞提供治疗的能力。
“我们需要找到一种既有效又有选择性的特定AA系留LNP,”Han说。“第一轮选择过程是通过检查我们的LNP敲低成纤维细胞中的绿色荧光蛋白(GFP)以测量效力来完成的。GFP为治疗性RNA如何实时关闭基因表达提供了很好的视觉证据。
“在第二轮中,我们测试了强效LNP的选择性能力,”韩说。“我们通过阻断sigma受体来了解特异性AA配体基团在LNP进入靶细胞的能力中的重要性。不出所料,我们发现AA组是显着的;在sigma受体阻断之后,我们失去了锁和钥匙机制,AA系留LNP不会进入 目标细胞."
研究小组将AA-T3A-C12确定为一种有效且选择性的LNP,携带治疗性siRNA,能够在小鼠中实现HSP47表达的65%敲低,并增强受损肝组织的恢复。研究结果得出结论,AA-T3A-C12 LNP优于MC3 LNP,MC3 LNP是一种临床利用的非病毒载体,已被FDA批准用于肝脏或肝脏细胞RNA治疗。
这种新的配体系留LNP提供了一种治疗形式 肝纤维化 合成方法提供了一种将LNP定制到体内其他以前难以靶向的细胞和组织的方法。
“LNP的潜力是巨大的,”Han说。“我们正在使LNP更智能,更高效。
“我们很高兴能够产生一种潜在的治疗方法,可以解决这种肝病的遗传根源,”米切尔说。“而且,由于这种LNP输送载体在肝脏的纤维化细胞中起作用,它可能导致开发一种治疗体内其他类型的纤维化的治疗方法,例如在肺部或肿瘤中出现的纤维化。
“除了我们在 肝,这种创建LNP的方法可用于解锁对其他细胞类型的治疗的递送,“他补充道。“我们可能 靶细胞 通过在可电离脂质结构中安装特定的靶向配体来在大脑、肺或心脏中。从这里有很多途径,我们很高兴继续将这项研究推向新的方向。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
