利用AI技术进行IVF胚胎选择
染色体数量异常(一种称为非整倍体的情况)是体外受精 (IVF) 胚胎无法植入或导致健康妊娠的主要原因。目前检测非整倍体的方法之一涉及对胚胎细胞进行活检样取样和基因检测。这种方法增加了 IVF 过程的成本并且对胚胎有侵入性。
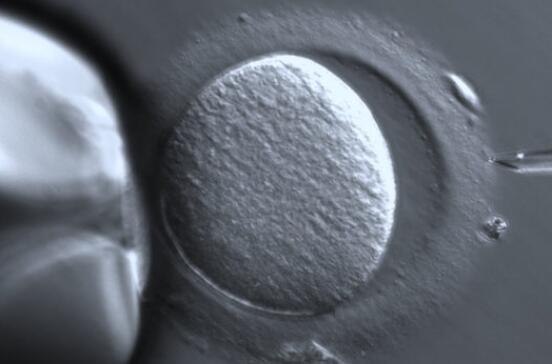
Lancet Digital Health 上发表的一篇论文中描述了新算法 STORK-A,它 可以帮助预测非整倍体,而没有活检的缺点。它通过分析胚胎的显微镜图像进行操作,并结合有关母亲年龄和 IVF 诊所对胚胎外观评分的信息。
“我们希望最终能够使用人工智能和计算机视觉技术以完全非侵入性的方式预测非整倍体,”该研究的资深作者 、威尔计算基因组学和生理学与生物物理学副教授Iman Hajirasouliha说。 Cornell Medicine 和 Englander Institute for Precision Medicine的成员。
该研究的第一作者是 Josue Barnes,他是 威尔康奈尔医学科学研究生院的博士生 ,也是 Hajirasouliha 实验室的成员。 Nikica Zaninovic 是威尔康奈尔医学院和纽约长老会/威尔康奈尔医学中心Ronald O. Perelman 和 Claudia Cohen 生殖医学中心的临床妇产科胚胎学副教授兼胚胎学实验室 主任,领导了胚胎学工作研究。
根据美国疾病控制和预防中心的数据,2020 年美国进行了超过 30 万次试管受精周期,约有 8 万例活产。IVF 专家一直在寻找提高成功率的方法,以更少的胚胎移植实现更成功的怀孕——这意味着开发更好的方法来识别可存活的胚胎。
生育诊所的工作人员目前使用显微镜来评估胚胎是否存在与生存能力差相关的大规模异常。为了获得有关染色体的信息,诊所工作人员还可以使用一种称为植入前非整倍体基因检测 (PGT-A) 的活检方法,主要针对 37 岁以上的女性。
为了开发一种胚胎评估的计算方法,利用胚胎学实验室对延时摄影的开创性使用,生殖医学中心的研究人员与英格兰德研究所的同事合作。
在 2019 年的一项研究中,该团队开发了一种人工智能算法 STORK,它可以评估胚胎质量以及 IVF 诊所工作人员。对于这项新研究,他们开发了 STORK-A 作为 PGT-A 的潜在替代品——或者作为一种更具选择性的方式来决定哪些胚胎应该进行 PGT-A 测试。
新的 STORK-A 算法使用受精后五天拍摄的胚胎显微镜图像、诊所工作人员对胚胎质量的评分、母亲年龄以及通常作为 IVF 过程的一部分收集的其他信息。因为它使用人工智能,该算法会自动“学习”将数据的某些特征与非整倍体的可能性相关联,这些特征对于人眼来说通常过于微妙。该团队在 10,378 个胚泡的数据集上训练了 STORK-A,这些胚泡的倍性状态已知。
根据其性能,他们评估了该算法在预测非整倍体与正常染色体“整倍体”胚胎方面的准确性为 69.3%。在预测涉及多条染色体的非整倍体(复杂非整倍体)与整倍体相比,STORK-A 的准确率为 77.6%。他们后来在独立数据集上测试了该算法,包括来自西班牙 IVF 诊所的一个数据集,并发现了相当的准确性结果,证明了 STORK-A 的普遍性。
该研究为目前处于实验阶段的方法提供了概念证明。将 STORK-A 在诊所中的使用标准化将需要将其与 PGT-A 进行比较的临床试验,以及食品和药物管理局的批准——在未来的所有年份。但新算法代表了在降低 IVF 胚胎选择风险、降低主观性、降低成本和提高准确性方面取得的进展。
“这是人工智能如何潜在地改变医学的另一个很好的例子。该算法将数以万计的胚胎图像转化为 AI 模型,这些模型最终可能用于帮助提高 IVF 疗效并通过降低成本进一步使访问民主化 。 ” Weill Cornell Medicine 的生理学和生物物理学以及计算生物医学中的计算基因组学。
“我们相信,最终通过使用这项技术,我们可以减少要进行活检的胚胎数量,降低成本,并在患者需要决定是否进行 PGT-A 时提供一个很好的咨询工具, ”扎尼诺维奇说。
该团队现在计划在这一成功的基础上,利用受过胚胎发育视频训练的算法。
“通过使用视频分类,”巴恩斯说,“我们可以利用有关胚胎发育的时间和空间信息,并希望能够检测发育趋势,以更高的准确性区分非整倍性和整倍性。”
“这项技术正在优化,希望在某个时候它的准确性将接近基因检测,这是黄金标准,准确率超过 90%,”合著者 Zev Rosenwaks 博士说,他是主任和医师- 纽约长老会/威尔康奈尔医学中心和威尔康奈尔医学院 Ronald O. Perelman 和 Claudia Cohen 生殖医学中心主任,以及威尔康奈尔医学院露华浓妇产科生殖医学杰出教授。“但我们意识到这个目标是有抱负的。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
