团队实现Ångström分辨率荧光显微镜
马克斯普朗克生物化学研究所(MPIB)和慕尼黑路德维希-马克西米利安大学(LMU)的Ralf Jungmann研究小组在荧光显微镜方面取得了突破。该团队开发了顺序成像分辨率增强(RESI),这是一项革命性的技术,可将荧光显微镜的分辨率提高到Ångström级。这项创新有望为我们研究生物系统的方法带来范式转变,迄今为止前所未有的细节。
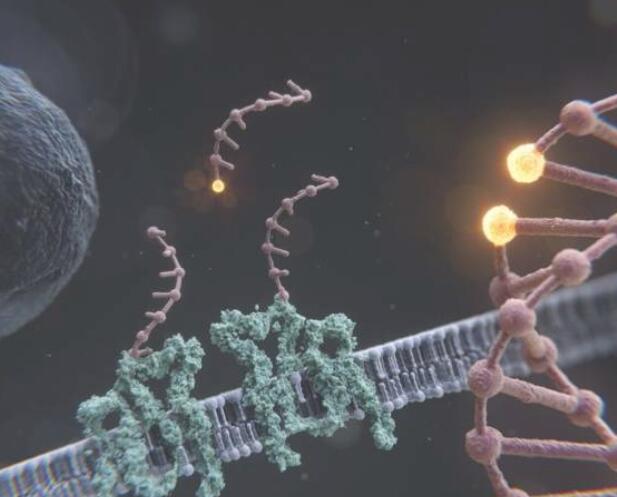
细胞是生命的基本单位,包含大量维持和延续生命系统的复杂结构、过程和机制。许多细胞核心成分,如DNA、RNA、蛋白质和脂质,只有几纳米的大小。这使得它们大大小于传统光学显微镜的分辨率极限。因此,这些分子和结构的确切组成和排列通常是未知的,导致对生物学基本方面缺乏机械理解。
近年来,超分辨率技术在分辨光的经典衍射极限以下的许多亚细胞结构方面取得了突飞猛进的进步。单分子定位显微镜(SMLM)是一种超分辨率方法,可以通过暂时分离其单个荧光发射来解析十纳米大小的结构。
当单个目标在其他黑暗的视野中随机点亮(它们闪烁)时,它们的位置可以用亚衍射精度确定。由Jungmann小组发明的DNA-PAINT是一种SMLM技术,它使用染料标记的DNA“成像器”链与其靶标结合补体的瞬时杂交,以实现超分辨率所需的闪烁。然而,迄今为止,即使是DNA-PAINT也无法解析最小的细胞结构。
在目前发表在《自然》杂志上的研究中,由共同第一作者Susanne Reinhardt,Luciano Masullo,Isabelle Baudrexel和Philipp Steen以及Jungmann领导,该团队在超分辨率显微镜中引入了一种新方法,该方法从根本上实现了“无限”的空间分辨率。
这项新技术称为通过顺序成像增强分辨率,简称RESI,利用DNA-PAINT通过独特的DNA序列编码目标身份的能力。通过标记相邻的靶标,即使通过超分辨率显微镜也无法分辨,使用不同的DNA链,将额外的分化程度(条形码)引入样品中。通过对第一个序列进行顺序成像,然后对另一个序列(从而对目标序列)进行成像,现在可以明确地分离它们。
至关重要的是,当它们按顺序成像时,目标可以任意接近彼此,这是其他技术无法解决的问题。此外,RESI不需要专门的仪器,事实上,它可以使用任何标准的荧光显微镜进行应用,使几乎所有研究人员都可以轻松使用。
为了证明RESI在分辨率上的飞跃,该团队为自己设定了解决生物系统中最小空间距离之一的挑战:沿着DNA双螺旋的单个碱基之间的分离,间隔不到一纳米。
通过设计DNA折纸纳米结构,使其呈现单链DNA序列,这些序列从一个碱基对距离从双螺旋突出,然后依次对这些单链进行成像,研究小组解决了相邻碱基之间0.85纳米(或8.5 Ångström)的距离,这是以前无法想象的壮举。研究人员以1 Ångström或10亿分之一米的精度完成了这些测量,强调了RESI方法前所未有的功能。
重要的是,该技术是通用的,不仅限于DNA纳米结构的应用。为此,研究小组研究了利妥昔单抗的分子作用模式,利妥昔单抗是一种抗CD20单克隆抗体,于1997年首次被批准用于治疗CD20阳性血癌。然而,研究这些药物分子对分子受体模式的影响已经超出了传统显微镜技术的空间分辨率能力。了解这些模式是否以及如何在健康和疾病以及治疗中发生变化,不仅对基本机制研究很重要,而且对设计新的靶向疾病疗法也很重要。
使用RESI,Jungmann和他的团队能够揭示未处理细胞中CD20受体作为二聚体的自然排列,并揭示CD20如何在药物治疗后重新排列成二聚体链。单蛋白水平的见解现在有助于阐明利妥昔单抗的分子作用模式。
由于RESI是在完整的完整细胞中进行的,因此该技术缩小了纯结构技术(如X射线晶体学或低温电子显微镜)与传统的低分辨率全细胞成像方法之间的差距。Jungmann和他的团队坚信,“这种前所未有的技术不仅对超分辨率,而且对整个生物学研究都是真正的游戏规则改变者。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
