酶ATE1在细胞应激反应中发挥作用为新的治疗靶点打开大门
《自然通讯》杂志上的一篇新论文阐明了一种以前知之甚少的酶如何在细胞中发挥作用。许多疾病与慢性细胞应激有关,UMBC的Aaron T. Smith及其同事发现这种酶在细胞应激反应中起着重要作用。更好地了解这种酶的功能和控制方式可能会导致发现这些疾病的新治疗靶点。
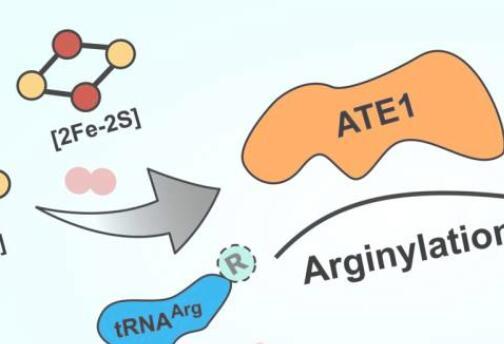
该酶被命名为ATE1,它属于称为精氨酸-tRNA转移酶的酶家族。这些酶将精氨酸(一种氨基酸)添加到蛋白质中,这通常会标记蛋白质在细胞中的破坏。破坏错误折叠的蛋白质,通常是由于细胞应激的结果,对于防止这些蛋白质对细胞功能造成严重破坏非常重要。功能失调的蛋白质的积累会导致身体出现严重问题,导致阿尔茨海默氏症或癌症等疾病,因此能够有效地摆脱这些蛋白质是长期健康的关键。
诱人的含义
这篇新论文表明,ATE1与铁和硫离子簇结合,并且当它与这些铁硫簇之一结合时,酶的活性会增加两到三倍。更重要的是,当研究人员阻断细胞产生簇的能力时,ATE1活性急剧下降。他们还发现ATE1对氧气高度敏感,他们认为这与它通过称为氧化应激的过程调节细胞应激反应的作用有关。
“我们对此感到非常兴奋,因为它有很多非常诱人的下游影响,”特别是与酶在疾病中的作用有关,化学和生物化学副教授史密斯说。
史密斯的实验室最初使用酵母蛋白,但也表明ATE1的小鼠版本表现相似。这很重要,史密斯解释说。“由于酵母蛋白和小鼠蛋白的行为方式相同,”他说,“有理由相信,因为人类蛋白质与小鼠蛋白质非常相似,所以它的行为方式也可能相同。
新方法
在他们做出突破性发现之前,史密斯和当时的研究生Verna Van,Ph.D. ' 22,生物化学和分子生物学,已经尝试了相当长的一段时间来诱导ATE1与血红素结合,血红素是一种含有铁的化合物,是结合血液中氧气所必需的,以确认另一组的结果。它不起作用,他们感到沮丧,史密斯承认。但有一天,当史密斯准备一个关于与金属和硫原子簇结合的蛋白质的讲座时,他意识到他即将与他的学生一起讨论的蛋白质看起来与ATE1相似。
在意识到这一点之后,史密斯和范采取了一种新的方法。在实验室中,他们将用于制造铁硫簇的原材料添加到具有ATE1的溶液中,结果表明ATE1确实与团簇结合。“这看起来很有希望,”史密斯回忆道。“我们对此感到非常兴奋。”
酶结合团簇的事实很有趣,也很新,“但后来我们也问这是否会影响酶做它所做的事情的能力,”史密斯说。经过一年多的额外实验,答案是肯定的。在此过程中,史密斯的小组还确定了酵母中 ATE1 的结构(没有与其结合的簇),并于 2022 年 <> 月发表在《分子生物学杂志》上。
微妙但意义重大
大约在同一时间,另一个小组也发表了一个略有不同的ATE1结构。另一组的结构有一个锌离子(另一种金属)代替铁硫簇结合。锌就位后,一个关键氨基酸旋转约60度。这似乎无关紧要,但史密斯认为,他认为与集群相似的旋转是集群在ATE1功能中的作用的关键。
旋转的氨基酸直接毗邻蛋白质与ATE1相互作用以进行修饰的位置,最终将其标记为降解。改变氨基酸的角度会改变蛋白质结合位置的形状“非常微妙”,但改变其活性“不仅仅是微妙”,史密斯说。
展望未来,回顾过去
史密斯还想探索除锌和铁硫簇之外的其他金属如何影响酶的活性。此外,他的实验室正在努力确定酵母以外的生物体中ATE1的结构,并确认ATE1结构与铁硫簇结合。
所有这些步骤将更清楚地了解ATE1在细胞中的功能和调节方式。史密斯还说,他认为迄今为止尚未被证明可以结合铁硫簇的蛋白质可能确实依赖于它们。
这篇新论文实际上让人想起史密斯在UMBC的第一天。他一直对蛋白质修饰感兴趣,添加精氨酸是一种更不寻常的修饰。“这一直是我脑海中浮现的东西,然后想,'哦,更好地了解它是如何工作的真的很有趣,'”他说。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
