研究人员发现了肿瘤进化的新方面和潜在的治疗靶点
路德维希癌症研究所的一项研究发现,免疫系统对癌症的监视本身可以诱导早期肿瘤细胞的代谢适应,同时促进它们的生长并使它们能够抑制致命的免疫反应。
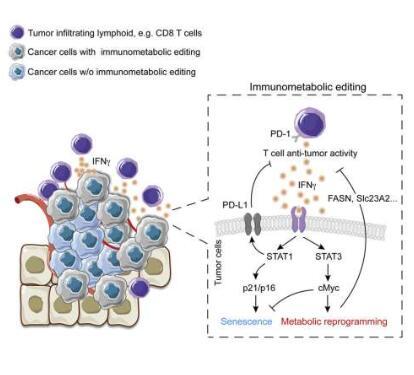
由 Ludwig Lausanne 副会员 Ping-Chih Ho 领导并发表在Cell Metabolism上的这项研究详细介绍了这种对新发肿瘤进行“免疫代谢编辑”的精确机制,它发生在皮肤癌黑色素瘤的小鼠模型中,并确定了一种新的生化信号级联和蛋白质协调它的效果。除了阐明肿瘤进化的一个以前未知的维度外,这些发现对提高癌症免疫疗法的疗效具有重要意义。
“我们已经发现了数十种有助于黑色素瘤免疫逃避的代谢酶,”Ho 说。“这些酶,以及我们已经确定的信号通路的一些单独成分,代表了丰富的潜在药物靶标,可以破坏免疫代谢编辑建立的防御系统。这些药物可能使肿瘤容易受到免疫清除,也可能与检查点封锁和其他免疫疗法结合使用,以克服大多数癌症对此类治疗的耐药性。”
免疫系统对癌症的监视被认为通过驱动可以破坏免疫检测和攻击机制的癌细胞的进化而导致恶性肿瘤。这种“免疫编辑”理论——最著名的是由 Ludwig 癌症研究所前科学主任兼首席执行官、已故的 Lloyd Old 和 Ludwig 现任科学顾问委员会成员 Robert Schreiber 开发的——现在是肿瘤免疫学的基本原理。
研究人员也早就知道,癌细胞常见的代谢适应性——例如它们对糖葡萄糖的狂热消耗——会破坏抗肿瘤免疫反应。然而,尚不清楚的是免疫监视是否也能诱导癌细胞的代谢适应,以及这些适应是否还能帮助它们抵抗免疫反应。这就是目前的研究已经确定的,揭示了肿瘤进化的一个方面,这个方面已经被假设,但迄今为止仍未得到证实。
Ho 和他的同事确定了协调这种效应的三种关键蛋白质:IFNγ、STAT3 和 c-Myc。IFNγ 是一种抗癌监测工具,由 T 细胞和其他免疫细胞分泌,已知可以阻止癌细胞的生长。但它触发的信号由一种名为 STAT1 的蛋白质介导,还会诱导癌细胞适应,帮助它们逃避 T 细胞攻击——这一过程称为免疫编辑。
研究人员在目前的研究中表明,IFNγ 还可以激活一种独特且鲜为人知的信号通路,该通路由一种名为 STAT3 的相关蛋白介导。该途径通过诱导决定哪些基因处于活动状态的“表观遗传”变化来改变癌细胞基因组的表达模式。它还过度激活细胞代谢的主要调节因子 c-Myc,它在许多癌症中过度表达。
研究人员表明,被 c-Myc 激活的基因不仅会影响癌症的新陈代谢,还会影响 T 细胞浸润到肿瘤中,并使它们无法攻击癌细胞。事实上,由 STAT1 和 STAT3 介导的信号通路似乎协同作用,赋予新发肿瘤避免免疫清除的关键能力,推动免疫代谢编辑,帮助推动它们演变成成熟的恶性肿瘤。
“之前的研究表明,癌细胞中 STAT3 活性的丧失会促进免疫浸润并诱导肿瘤消退,”Ho 说。“我们在这里的发现解释了为什么并表明用药物靶向 STAT3 可以恢复已经进化到超出其抑制范围的癌细胞对 IFNγ 的敏感性。”
研究人员还利用 CRISPR 基因组编辑技术筛选了小鼠肿瘤中的 2078 种代谢酶,鉴定出 40 种由 c-Myc 控制的代谢基因,这些基因在帮助癌细胞逃避免疫监视和攻击方面发挥着重要作用。这些酶也是药物靶向的主要候选者。
“除了它的药理学意义,”Ho 说,“这项研究揭示了免疫编辑以前未被重视的一个方面,它将影响我们对肿瘤微环境中癌细胞和免疫细胞之间代谢串扰的理解。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
