研究人员揭示了DNA解压缩机器MCM2-7复合体的工作原理
大学(港大)生物科学学院翟元良博士带领的研究团队,以及科技大学(科大)和法国居里研究所的合作者,发现了一个新的人类 MCM2-7 复合物调节复制起始的机制,可作为一种新型有效的抗癌策略,具有选择性癌细胞的潜力。该研究结果最近发表在Cell上。
人类的生命始于母亲子宫中的一个受精卵。这个卵通过细胞分裂繁殖并发育成我们的多细胞体。在每次细胞分裂过程中,我们的基因组 DNA,即遗传信息的蓝图,都会被准确复制。每个细胞携带大约 2 米长的 DNA,这些 DNA 被组织成 23 对染色体。在我们的一生中(约 70 年),我们的身体将合成超过 1 光年长度的 DNA,约 10 16米——光在一年内传播的距离。复制过程需要先将 DNA 双链体解链,然后分离成两条单链模板,供 DNA 聚合酶合成为互补链。这个过程的任何错误调节都可能导致可怕的后果,例如肿瘤发生和遗传性遗传病。
大学生物科学学院助理教授翟元良博士说:“解开 DNA复制的秘密是理解生命之谜的关键,解决复制机器的结构对于了解其分子功能至关重要,眼见为实”
自 1953 年詹姆斯·沃森 (James Watson) 和弗朗西斯·克里克 (Francis Crick) 确定 DNA 的结构以来,DNA 双链体最初是如何熔化的,这一直是生物学家长期悬而未决的问题。在真核生物中,负责在复制过程中解压缩 DNA 双链体的酶最初是由我们的合作者康奈尔大学的 Bik-Kwoon Tye 教授于 1983 年从酿酒酵母中鉴定为微型染色体维持蛋白复合物 (MCM) 基因。六个 MCM 基因的产物, MCM2 到 MCM7 (MCM2-7), 形成一个六亚基环状复合体,作为解链机器的催化核心,即 DNA 复制解旋酶。
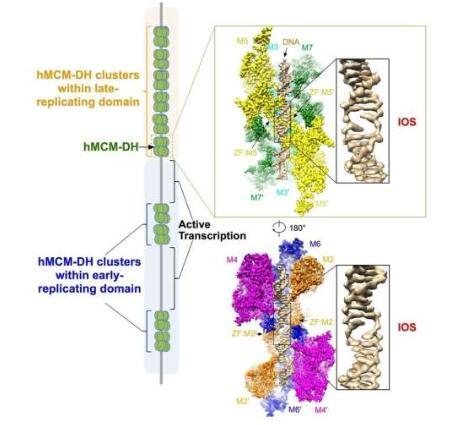
在细胞中,要启动 DNA 复制,必须首先将 MCM2-7 复合体组装成头对头双六聚体 (DH),在每条染色体的数千个位置环绕双链 DNA。在大量组装的 MCM2-7 DH 中,最终只会选择其中的一个子集并将其转化为用于 DNA 解旋的强大的复制解旋酶。人们认为 MCM2-7 DH 可以直接破坏 DNA 的稳定性,从而触发双链 DNA 的初始打开。然而,潜在的机制在很大程度上仍然未知。
为了解决这个问题,研究团队试图使用尖端技术冷冻电子显微镜(cryo-EM) 来可视化 MCM2-7 DH 的原子细节,这些细节比分辨率极限小数百万倍人类的眼睛。
2015 年,该团队解决了第一个从酵母中分离出来的 3.8 Å 的 MCM2-7 DH 冷冻电镜结构,该结构被记录在《自然》杂志上。不幸的是,捕获的 DNA 不稳定,无法告知 MCM2-7 DH 结合的 DNA 双链体的状态。
最近,研究人员成功地从培养的人类细胞中纯化出 MCM2-7 DH,并确定其结构位于 2.59 Å。这个高分辨率结构清楚地展示了 MCM2-7 复合物如何使 DNA 不稳定,从而在两个偶联的 MCM2-7 六聚体的连接处引起 DNA 双链体的初始打开。
该团队还发现,MCM2-7 DH 被加载到人类基因组数万个位点的 DNA 上,这些位点与活跃转录位点互斥。此外,当这种初始开放结构受到干扰时,MCM2-7 DH 将无法再组装到 DNA 上,从而导致 DNA 复制启动的完全抑制。
科技大学生命科学部助理教授党尚宇博士说:“原子分辨率的冷冻电镜结构能够直接观察到最初的 DNA 熔解,这对我们了解 DNA 复制的分子机制至关重要。”这项研究还证明了合作的重要性。需要具有互补专业知识的研究小组的努力来回答基本的生物学问题。”
几种治疗性癌症药物已将 DNA 复制作为目标。然而,可用的药物不分青红皂白地所有分裂细胞,因为正常细胞和癌细胞都必须复制其 DNA 才能进行细胞增殖。因此,这些药物的特异性引起了对这些抗癌化学疗法的严重关注。一个更可取的选择是抑制 DNA 复制启动,使正常细胞停滞在 G1 期(第一生长期)或退出细胞周期进入 G0 状态(静止期);但癌细胞会发生凋亡。因此,抑制复制起始可作为一种新型有效的抗癌策略,具有选择性癌细胞的潜力。
本研究的发现提供了有关人类启动前复合物的高分辨率结构和机制信息,未来可用于开发以 MCM2-7 复合物为靶点的无毒抗癌药物。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【首都师范大学是211吗】一、“首都师范大学是211吗”是许多考生和家长在选择大学时经常提出的问题。实际上,...浏览全文>>
-
【首都师范大学科德学院自考和统招毕业证不一样吗有什么不一样的】在选择继续教育方式时,很多学生都会关注“...浏览全文>>
-
【首都师范大学科德学院自考本科国家承认学历吗】一、“首都师范大学科德学院自考本科国家承认学历吗”是许多...浏览全文>>
-
【首都师范大学科德学院怎么样首都师范大学科德学院介绍】首都师范大学科德学院是一所位于北京市的全日制本科...浏览全文>>
-
【第一次电影剧情】《第一次》是一部由美国导演理查德·林克莱特(Richard Linklater)执导的电影,于2004年...浏览全文>>
-
【首都师范大学科德学院学费一年多少钱】首都师范大学科德学院是一所经教育部批准设立的全日制本科独立学院,...浏览全文>>
-
【第一次点外卖的流程】对于第一次尝试点外卖的人来说,整个过程可能会有些陌生。不过,只要按照步骤来,就能...浏览全文>>
-
【首都师范大学科德学院学费为什么要这么贵】首都师范大学科德学院作为一所独立学院,近年来在学费方面引发了...浏览全文>>
-
【第一次登泰山的忌讳】泰山,作为五岳之首,不仅是中国文化的重要象征,也是无数人心中的朝圣之地。对于第一...浏览全文>>
-
【首都师范大学科德学院位于哪个城市】首都师范大学科德学院是一所独立学院,隶属于首都师范大学。对于许多学...浏览全文>>
